A SNatural não fornece mais Produtos Químicos, este material é exclusivo para transmitir conhecimento.
Produtos Químicos para Tratamento de Água
Qualidade da Água
As águas naturais contêm substâncias e elementos essenciais ao desenvolvimento do ser humano. Por outro lado, as águas naturais podem conter organismos, substâncias, compostos e elementos prejudiciais à saúde. Água potável não é água pura, quimicamente falando. Na realidade, a água potável é uma solução de uma infinidade de substâncias, algumas das quais a água trouxe consigo da natureza e outras que podem ser introduzidas ao longo dos processos de tratamento.
Parâmetros de Qualidade de Água
- pH – É usado universalmente para exprimir a intensidade com que determinada solução é ácida ou alcalina. Diz-se que a solução é ácida se seu pH é inferior a 7, e que ela é alcalina se seu pH é superior a 7. Uma solução, cujo pH é igual a 7, é neutra. Para tratamento da água, o pH é, sem dúvida, um dos mais importantes parâmetros uma vez que existe um pH ótimo de floculação e decantação.
- Cor – A cor natural das águas potáveis deve-se à variedade de substâncias que podem estar presentes, sob forma de solução, A cor aparente é dada por uma água não centrifugada e a real é dada após separarmos as partículas em suspensão presentes.
- Turbidez – Diz-se que a água é turva quando contém matérias em suspensão, que interferem com a passagem da luz através dela, ou na qual é restringida a visão em profundidade de certa amostra. A turbidez das águas é devida à presença de partículas em estado coloidal, em suspensão, matéria orgânica e inorgânica finamente dividida, plancton e outros organismos microscópios. Evidentemente ela tende a ser mais alta nos cursos d’agua, nos quais a água está em constante agitação, e menor nos lagos, nos quais o repouso da água permite a sedimentação das matérias em suspensão. A turbidez pode variar de zero, em águas puras, até centenas ou milhares de unidades, em cursos d’agua poluídos. As leituras são determinadas são em unidades nefelométricas de turbidez (UNT ou NTU).
- Alcalinidade – O termo alcalinidade traduz a capacidade de certa água em neutralizar ácidos. Quanto maior a alcalinidade de uma água, maior é a dificuldade que ela apresentará para variar seu pH quando lhe aplicamos um ácido ou uma base.
De modo geral, a alcalinidade das águas naturais está relacionada com a presença de sais de ácidos fracos, especialmente bicarbonatos. Esses sais, quando presentes, resultam da ação da água sobre os carbonatos presentes no solo, especialmente bicarbonatos de cálcio. Em laboratório se determina os valores da alcalinidade total, da alcalinidade de bicarbonatos e da alcalinidade de carbonatos.
- Dureza – Denomina-se genericamente de águas duras aquelas que necessitam de grandes quantidades de sabão para produzirem espuma, e que, além disto, incrustam caldeiras, aquecedores, tubulações de água quente e outras unidades em que a água escoa submetida a temperaturas elevadas. Águas de superfície são mais brandas que as subterrâneas. (poços) tendo em vista que a qualidade das águas reflete a natureza das formações geológicas com as quais entra em contato. De modo geral, ela é devida à presença de cálcio e magnésio.
Quando o cálcio e o magnésio ocorrem nas águas naturais, eles costumam estar associados a carbonatos e bicarbonatos, assim nossas águas, quando duras, em geral são também alcalinas. Por este motivo, as análises de dureza expressam seus resultados em termos de CaCO3, independentemente de seu agente causador.
Classificação para as águas, conforme sua dureza:
Branda: 0 a 75 mg/l de CaCO3. Moderadamente dura: 75 a 150 mg/l de CaCO3. Dura: 150 a 300 mg/l de CaCO3 .Muito dura: acima de 300 mg/l de CaCO3
- Ferro – O ferro é um dos metais mais abundantes da crosta terrestre. Pode ser encontrado nas águas naturais em concentrações que variam de 0,5 a 50 mg/l. É um elemento nutricional essencial ao ser humano. Quando presente na água em sua forma solúvel, ele é incolor, porém oxidado, devido à aeração ou cloração da água, ele se precipita na água com uma cor avermelhada que tende a assustar os consumidores.
A Organização Mundial da Saúde não estabelece concentrações limite para esse metal. Cita que concentrações da ordem de 2 mg/l podem ser consumidas sem risco para a saúde, mas adverte que concentrações superiores a esse valor podem levar à rejeição da água por parte dos consumidores, por comunicarem-lhe certo sabor ou por razões estéticas.
- Manganês – O manganês é um dos metais mais abundantes da crosta terrestre e geralmente é encontrado junto com o ferro. Quando presente na água em sua forma solúvel, ele é incolor. Porém, se, por alguma razão, ele é oxidado (devido à aeração ou cloração da água se precipita na água. Esse precipitado tem cor negra e tende a assustar os consumidores. Não existem estudos conclusivos capazes de associar a presença de manganês à saúde humana. A Organização Mundial da Saúde estabelece a concentração de 0,5 mg/l para esse metal, mas reconhece que concentrações superiores a esse valor podem levar à rejeição da água por parte dos consumidores, por razões estéticas.
- Cloretos – A presença de cloretos na água pode estar atribuída à existência de jazidas naturais no caminho percorrido por ela (salgema, por exemplo), e também à poluição por esgotos sanitários e efluentes industriais. Concentrações excessivas de cloretos aceleram a corrosão dos metais. No caso de sistemas distribuidores construídos utilizando tubulações metálicas, cloretos em excesso aumentarão a concentração dos metais na água potável, em virtude da corrosão das canalizações. Existem fontes mais importantes de cloretos que a água potável às quais o ser humano se encontra exposto, tais como as saladas consumidas nas refeições e que são temperadas com sal (cloreto de sódio). Não obstante, concentrações de cloretos superiores a 250 mg/l causam gosto perceptível à água, e tendem a ser rejeitadas.
- Sulfatos – Diversos minerais presentes na natureza contém sulfatos, podendo, por este motivo, atingir as águas. Entretanto, eles podem estar presentes em efluentes de diversas atividades industriais, especialmente químicas. O íon sulfato é pouco tóxico, mas pode ter efeito purgativo. O sulfato de magnésio foi utilizado durante muito tempo com essa finalidade. O Valor limite de 500 mg/l foi estabelecido por essa razão. A presença de sulfatos pode comunicar certo gosto perceptível pelo consumidor, e contribuir para acelerar a corrosão dos materiais metálicos componentes de redes distribuidoras.
- Coliformes totais e fecais – As análises bacteriológicas visam à determinação da presença de bactérias denominadas coliformes.Totais bactérias que vivem no trato intestinal de animais de sangue quente, entre eles o homem, mas existem algumas espécies de vida livre, isto é, que podem viver no solo. Daí o fato de se efetuar análises para a determinação de coliformes totais e fecais. A presença de coliformes fecais na água indica a possibilidade de contaminação por fezes humanas, embora não comprove. Por este motivo, diz-se que os coliformes são indicadores de contaminação.
Ressalte-se que os coliformes, por si só, não são patogênicos quando presentes nas concentrações usuais no ser humano, mas sua presença na água indica a possibilidade da presença de organismos patogênicos.
Produtos Químicos usados no Tratamento de Água
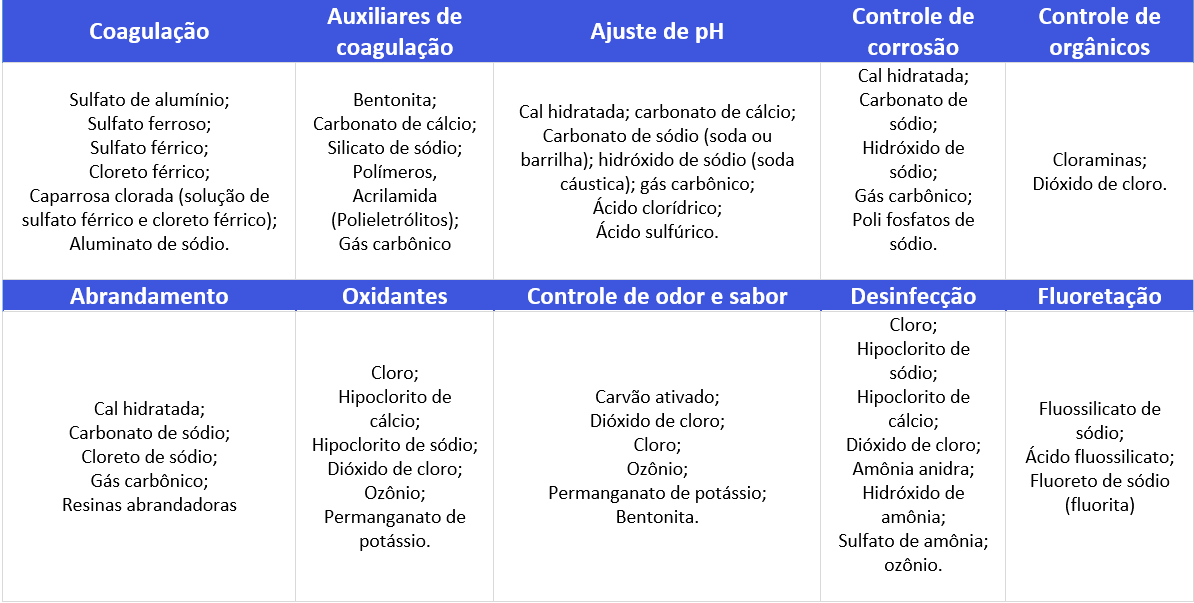
Tabela de Produtos Químicos usados no Tratamento de Água
- Coagulação – As impurezas contidas na água podem encontrar-se em Suspensão ou Dissolvidas. As suspensões podem ser do tipo grosseiras, facilmente capazes de flutuar ou decantar quando a água estiver em repouso (ex: folhas, sílica, restos vegetais, etc.); podem ainda ser do tipo fino, representado pela turbidez, bactérias, plankton, etc. e as coloidais, representadas pelas emulsões (CO2), ferro e manganês oxidado, etc.
As impurezas dissolvidas são a dureza (sais de cálcio e magnésio), ferro e manganês não oxidados. A coagulação tem por objetivo aglomerar as impurezas que se encontram em suspensão ou em estado coloidal e algumas que se encontram dissolvidas em partículas maiores que possam ser removidas por decantação ou filtração.
Este fenômeno de aglomeração ocorre devido à duas ações distintas:
- Desestabilidade por adição de produtos químicos que neutralizam as forcas elétricas superficiais e se anulam as forcas repulsivas (coagulação) e (b) aglomeração dos coloides “descarregados” até a formação de flocos que sedimentam a uma velocidade adequada. Esta aglomeração ou floculação é facilitada pela agitação suave para facilitar o contato dos flocos uns com os outros sem, contudo, quebrá-los.
Os reagentes utilizados no processo de coagulação:
- Coagulantes, geralmente de ferro ou alumínio são capazes de produzir hidróxidos gelatinosos insolúveis e englobar as impurezas.
- Alcalinizantes são capazes de conferir a alcalinidade necessária à coagulação (cal viva – óxido de cálcio; hidróxido de cálcio; hidróxido de sódio – soda caustica; carbonato de sódio – barrilha) e os
- Coadjuvantes capazes de formar partículas mais densas e tornar os flocos mais lastrados (argila, sílica ativa, polieletrólitos, etc.).
Os Coagulantes reagem com álcalis produzindo hidróxidos gelatinosos que envolvem e adsorvem impurezas (remoção de turbidez) e produzem íons trivalentes de cargas elétricas positivas, que atraem e neutralizam as cargas elétricas dos coloides que, em geral são negativas (remoção de cor).
Os fatores que influenciam a coagulação são: espécie de coagulante, quantidade de coagulante, turbidez e cor a serem removidas, teor bacteriológico, quantidade de coloides, quantidade de emulsificantes, substancias coloridas diversas, alcalinidade, teor de ferro, matéria orgânica, pH, há um pH ótimo de floculação, que é determinado experimentalmente, tempo de misturas rápidas e lenta, temperatura, agitação e presença de núcleos.
Coagulantes Utilizados
O sulfato de alumínio é o mais utilizado entre os coagulantes. É um sólido cristalino de cor branco-acinzentada contendo 17% de Al2O3 solúvel em água. É disponível em pedra, pó ou em soluções concentradas. Na água o Al2(SO4)3 . 18H2O reage com a alcalinidade natural formando o Al(OH)3. O Al(OH)3 irá formar os flocos e o CO2 é o responsável pelo aumento da acidez da água. Quando a alcalinidade natural é reduzida, geralmente adiciona-se cal ((Ca(OH))2 ou carbonato de sódio Na2CO3.
Outros coagulantes e adjuvantes

Tabela de coagulantes e adjuvantes
- Alcalinizantes: Dentre os alcalinizantes o mais utilizado, pelo seu baixo custo, é a Cal (cal virgem ou viva, cal hidratada ou extinta, cal dolomítica, são outras denominações do óxido de cálcio). Pode também ser utilizado o hidróxido de cálcio [CaOH)2] e de misturas deste com o óxido de magnésio (MgO) e o hidróxido de magnésio [Mg(OH)2].
- Cal Virgem – Ca O da ordem 80% (rejeitar com menos de 70%)
- Cal Hidratada – Ca O da ordem 90% (rejeitar <60%)
- Carbonato de Sódio (barrilha) Na2CO3 – 99,4% de Na2 CO3 e 58 % de Na2O
- Auxiliares de Coagulação: Dificuldades com a coagulação, frequentemente, ocorrem devido aos precipitados de baixa decantação, ou flocos frágeis que são facilmente fragmentados sob forças hidráulicas, nos decantadores e filtros de areia. Os auxiliares de coagulação beneficiam a floculação, aumentando a decantação e o enrijecimento dos flocos. Os materiais mais utilizados são os polieletrólitos, a sílica ativada, agentes adsorventes de peso e oxidantes.
- Polímeros Sintéticos ou Polieletrólitos: São substâncias químicas orgânicas de cadeia longa e alto peso molecular, disponíveis numa variedade de nomes comerciais. Polieletrólitos são classificados de acordo com a carga elétrica na cadeira do polímero, os carregados positivamente são chamados de catiônicos e os que não possuem carga elétrica são os não-iônicos. Os Antônimos e os não-iônicos são geralmente utilizados com coagulantes metálicos para promoverem a ligação entre os coloides, a fim de desenvolver flocos maiores e mais resistentes.
A dosagem requerida de um auxiliar de coagulação é da ordem de 0,1 a 1,0 mg/L. Na coagulação de algumas águas, os polímeros podem promover floculação satisfatória, com significativa redução das dosagens de sulfato de alumínio. As vantagens potenciais são a reduções da quantidade de lodo e maior facilidade para desidratação.
- Polímeros Catiônicos: Tem sido usados com sucesso, em alguns casos, como coagulantes primários. Embora o custo destes polímeros seja maior que o do sulfato, as dosagens requeridas são reduzidas, podendo igualar o custo final. Adicionalmente, ao contrario do lodo gelatinoso e volumoso oriundo do sulfato de alumínio, o lodo formado pelo uso de polímeros é mais denso e fácil de ser desidratado, facilitando o manuseio e disposição. Algumas vezes, polímeros catiônicos e não-iônicos podem ser usados conjuntamente para formar um fluxo adequado, o primeiro sendo coagulante primário e segundo auxiliar de coagulação. Apesar de diversos avanços neste campo, existem varias águas que não podem ser tratadas apenas com polieletrólitos. Testes devem ser realizados para obtenção da eficiência um polieletrólito no tratamento de uma determinada água.
- Sílica Ativada: É o silicato de sódio tratado com ácido sulfúrico, sulfato de alumínio, dióxido de carbono ou cloro. Como auxiliar de coagulação ela apresenta as seguintes vantagens: aumenta a taxa de reação química, reduz a dosagem de coagulante, aumenta a faixa de pH ótimo e produz um floco com melhores propriedades de decantação e resistência. A desvantagem em relação aos polieletrólitos é a necessidade de um controle preciso de preparo e dosagem.
Dosagem de 7 a 11% da dosagem do coagulante primário expresso em mg/L de SiO2. Quando utilizada junto com o sulfato de alumínio ou sulfato ferroso, a sílica, por sua elevada carga negativa, promove a formação de flocos maiores, mais densos e resistentes, o que aumenta a eficiência de coagulação. A sílica, mesmo um pequenas quantidades causa prejuízos as caldeiras à vapor.
- Argilas Bentoniticas: Usadas no tratamento de águas contendo alto teor de cor, baixa turbidez e baixo conteúdo mineral. Nestas condições, os flocos de Fe ou Al são demasiadamente leves para decantar rapidamente. A adição da argila resulta num aumento de peso do floco melhorando a decantabilidade. A dosagem deve ser feita na forma de testes mas as dosagens são da ordem de 10 a 15 mg/L.
- Carvão Ativado: Aplicam na forma de pó, tem grande poder de adsorção. É bastante empregada no tratamento da água com gosto e odor provocador por material orgânico.
- Ácido Sulfúrico: É usado como auxiliar na coagulação de águas de cor e pH bastante elevados.
Produtos Químicos para Tratamento de Água
Qualidade da Água
As águas naturais contêm substâncias e elementos essenciais ao desenvolvimento do ser humano. Por outro lado, as águas naturais podem conter organismos, substâncias, compostos e elementos prejudiciais à saúde. Água potável não é água pura, quimicamente falando. Na realidade, a água potável é uma solução de uma infinidade de substâncias, algumas das quais a água trouxe consigo da natureza e outras que podem ser introduzidas ao longo dos processos de tratamento.
Parâmetros de Qualidade de Água
- pH – É usado universalmente para exprimir a intensidade com que determinada solução é ácida ou alcalina. Diz-se que a solução é ácida se seu pH é inferior a 7, e que ela é alcalina se seu pH é superior a 7. Uma solução, cujo pH é igual a 7, é neutra. Para tratamento da água, o pH é, sem dúvida, um dos mais importantes parâmetros uma vez que existe um pH ótimo de floculação e decantação.
- Cor – A cor natural das águas potáveis deve-se à variedade de substâncias que podem estar presentes, sob forma de solução, A cor aparente é dada por uma água não centrifugada e a real é dada após separarmos as partículas em suspensão presentes.
- Turbidez – Diz-se que a água é turva quando contém matérias em suspensão, que interferem com a passagem da luz através dela, ou na qual é restringida a visão em profundidade de certa amostra. A turbidez das águas é devida à presença de partículas em estado coloidal, em suspensão, matéria orgânica e inorgânica finamente dividida, plancton e outros organismos microscópios. Evidentemente ela tende a ser mais alta nos cursos d’agua, nos quais a água está em constante agitação, e menor nos lagos, nos quais o repouso da água permite a sedimentação das matérias em suspensão. A turbidez pode variar de zero, em águas puras, até centenas ou milhares de unidades, em cursos d’agua poluídos. As leituras são determinadas são em unidades nefelométricas de turbidez (UNT ou NTU).
- Alcalinidade – O termo alcalinidade traduz a capacidade de certa água em neutralizar ácidos. Quanto maior a alcalinidade de uma água, maior é a dificuldade que ela apresentará para variar seu pH quando lhe aplicamos um ácido ou uma base.
De modo geral, a alcalinidade das águas naturais está relacionada com a presença de sais de ácidos fracos, especialmente bicarbonatos. Esses sais, quando presentes, resultam da ação da água sobre os carbonatos presentes no solo, especialmente bicarbonatos de cálcio. Em laboratório se determina os valores da alcalinidade total, da alcalinidade de bicarbonatos e da alcalinidade de carbonatos.
Dureza – Denomina-se genericamente de águas duras aquelas que necessitam de grandes quantidades de sabão para produzirem espuma, e que, além disto, incrustam caldeiras, aquecedores, tubulações de água quente e outras unidades em que a água escoa submetida a temperaturas elevadas. Águas de superfície são mais brandas que as subterrâneas. (poços) tendo em vista que a qualidade das águas reflete a natureza das formações geológicas com as quais entra em contato. De modo geral, ela é devida à presença de cálcio e magnésio.
Quando o cálcio e o magnésio ocorrem nas águas naturais, eles costumam estar associados a carbonatos e bicarbonatos, assim nossas águas, quando duras, em geral são também alcalinas. Por este motivo, as análises de dureza expressam seus resultados em termos de CaCO3, independentemente de seu agente causador.
Classificação para as águas, conforme sua dureza:
Branda: 0 a 75 mg/l de CaCO3. Moderadamente dura: 75 a 150 mg/l de CaCO3. Dura: 150 a 300 mg/l de CaCO3 .Muito dura: acima de 300 mg/l de CaCO3
- Ferro – O ferro é um dos metais mais abundantes da crosta terrestre. Pode ser encontrado nas águas naturais em concentrações que variam de 0,5 a 50 mg/l. É um elemento nutricional essencial ao ser humano. Quando presente na água em sua forma solúvel, ele é incolor, porém oxidado, devido à aeração ou cloração da água, ele se precipita na água com uma cor avermelhada que tende a assustar os consumidores.
A Organização Mundial da Saúde não estabelece concentrações limite para esse metal. Cita que concentrações da ordem de 2 mg/l podem ser consumidas sem risco para a saúde, mas adverte que concentrações superiores a esse valor podem levar à rejeição da água por parte dos consumidores, por comunicarem-lhe certo sabor ou por razões estéticas.
- Manganês – O manganês é um dos metais mais abundantes da crosta terrestre e geralmente é encontrado junto com o ferro. Quando presente na água em sua forma solúvel, ele é incolor. Porém, se, por alguma razão, ele é oxidado (devido à aeração ou cloração da água se precipita na água. Esse precipitado tem cor negra e tende a assustar os consumidores. Não existem estudos conclusivos capazes de associar a presença de manganês à saúde humana. A Organização Mundial da Saúde estabelece a concentração de 0,5 mg/l para esse metal, mas reconhece que concentrações superiores a esse valor podem levar à rejeição da água por parte dos consumidores, por razões estéticas.
- Cloretos – A presença de cloretos na água pode estar atribuída à existência de jazidas naturais no caminho percorrido por ela (salgema, por exemplo), e também à poluição por esgotos sanitários e efluentes industriais. Concentrações excessivas de cloretos aceleram a corrosão dos metais. No caso de sistemas distribuidores construídos utilizando tubulações metálicas, cloretos em excesso aumentarão a concentração dos metais na água potável, em virtude da corrosão das canalizações. Existem fontes mais importantes de cloretos que a água potável às quais o ser humano se encontra exposto, tais como as saladas consumidas nas refeições e que são temperadas com sal (cloreto de sódio). Não obstante, concentrações de cloretos superiores a 250 mg/l causam gosto perceptível à água, e tendem a ser rejeitadas.
- Sulfatos – Diversos minerais presentes na natureza contém sulfatos, podendo, por este motivo, atingir as águas. Entretanto, eles podem estar presentes em efluentes de diversas atividades industriais, especialmente químicas. O íon sulfato é pouco tóxico, mas pode ter efeito purgativo. O sulfato de magnésio foi utilizado durante muito tempo com essa finalidade. O Valor limite de 500 mg/l foi estabelecido por essa razão. A presença de sulfatos pode comunicar certo gosto perceptível pelo consumidor, e contribuir para acelerar a corrosão dos materiais metálicos componentes de redes distribuidoras.
- Coliformes totais e fecais – As análises bacteriológicas visam à determinação da presença de bactérias denominadas coliformes.Totais bactérias que vivem no trato intestinal de animais de sangue quente, entre eles o homem, mas existem algumas espécies de vida livre, isto é, que podem viver no solo. Daí o fato de se efetuar análises para a determinação de coliformes totais e fecais. A presença de coliformes fecais na água indica a possibilidade de contaminação por fezes humanas, embora não comprove. Por este motivo, diz-se que os coliformes são indicadores de contaminação.
Ressalte-se que os coliformes, por si só, não são patogênicos quando presentes nas concentrações usuais no ser humano, mas sua presença na água indica a possibilidade da presença de organismos patogênicos.
Produtos Químicos usados no Tratamento de Água

Tabela de Produtos Químicos usados no Tratamento de Água
- Coagulação – As impurezas contidas na água podem encontrar-se em Suspensão ou Dissolvidas. As suspensões podem ser do tipo grosseiras, facilmente capazes de flutuar ou decantar quando a água estiver em repouso (ex: folhas, sílica, restos vegetais, etc.); podem ainda ser do tipo fino, representado pela turbidez, bactérias, plankton, etc. e as coloidais, representadas pelas emulsões (CO2), ferro e manganês oxidado, etc.
As impurezas dissolvidas são a dureza (sais de cálcio e magnésio), ferro e manganês não oxidados. A coagulação tem por objetivo aglomerar as impurezas que se encontram em suspensão ou em estado coloidal e algumas que se encontram dissolvidas em partículas maiores que possam ser removidas por decantação ou filtração.
Este fenômeno de aglomeração ocorre devido à duas ações distintas:
- Desestabilidade por adição de produtos químicos que neutralizam as forcas elétricas superficiais e se anulam as forcas repulsivas (coagulação) e (b) aglomeração dos coloides “descarregados” até a formação de flocos que sedimentam a uma velocidade adequada. Esta aglomeração ou floculação é facilitada pela agitação suave para facilitar o contato dos flocos uns com os outros sem, contudo, quebrá-los.
Os reagentes utilizados no processo de coagulação:
- Coagulantes, geralmente de ferro ou alumínio são capazes de produzir hidróxidos gelatinosos insolúveis e englobar as impurezas.
- Alcalinizantes são capazes de conferir a alcalinidade necessária à coagulação (cal viva – óxido de cálcio; hidróxido de cálcio; hidróxido de sódio – soda caustica; carbonato de sódio – barrilha) e os
- Coadjuvantes capazes de formar partículas mais densas e tornar os flocos mais lastrados (argila, sílica ativa, polieletrólitos, etc.).
Os Coagulantes reagem com álcalis produzindo hidróxidos gelatinosos que envolvem e adsorvem impurezas (remoção de turbidez) e produzem íons trivalentes de cargas elétricas positivas, que atraem e neutralizam as cargas elétricas dos coloides que, em geral são negativas (remoção de cor).
Os fatores que influenciam a coagulação são: espécie de coagulante, quantidade de coagulante, turbidez e cor a serem removidas, teor bacteriológico, quantidade de coloides, quantidade de emulsificantes, substancias coloridas diversas, alcalinidade, teor de ferro, matéria orgânica, pH, há um pH ótimo de floculação, que é determinado experimentalmente, tempo de misturas rápidas e lenta, temperatura, agitação e presença de núcleos.
Coagulantes Utilizados
O sulfato de alumínio é o mais utilizado entre os coagulantes. É um sólido cristalino de cor branco-acinzentada contendo 17% de Al2O3 solúvel em água. É disponível em pedra, pó ou em soluções concentradas. Na água o Al2(SO4)3 . 18H2O reage com a alcalinidade natural formando o Al(OH)3. O Al(OH)3 irá formar os flocos e o CO2 é o responsável pelo aumento da acidez da água. Quando a alcalinidade natural é reduzida, geralmente adiciona-se cal ((Ca(OH))2 ou carbonato de sódio Na2CO3.
Outros coagulantes e adjuvantes

Tabela de coagulantes e adjuvantes
- Alcalinizantes: Dentre os alcalinizantes o mais utilizado, pelo seu baixo custo, é a Cal (cal virgem ou viva, cal hidratada ou extinta, cal dolomítica, são outras denominações do óxido de cálcio). Pode também ser utilizado o hidróxido de cálcio [CaOH)2] e de misturas deste com o óxido de magnésio (MgO) e o hidróxido de magnésio [Mg(OH)2].
- Cal Virgem – Ca O da ordem 80% (rejeitar com menos de 70%)
- Cal Hidratada – Ca O da ordem 90% (rejeitar <60%)
- Carbonato de Sódio (barrilha) Na2CO3 – 99,4% de Na2 CO3 e 58 % de Na2O
- Auxiliares de Coagulação: Dificuldades com a coagulação, frequentemente, ocorrem devido aos precipitados de baixa decantação, ou flocos frágeis que são facilmente fragmentados sob forças hidráulicas, nos decantadores e filtros de areia. Os auxiliares de coagulação beneficiam a floculação, aumentando a decantação e o enrijecimento dos flocos. Os materiais mais utilizados são os polieletrólitos, a sílica ativada, agentes adsorventes de peso e oxidantes.
- Polímeros Sintéticos ou Polieletrólitos: São substâncias químicas orgânicas de cadeia longa e alto peso molecular, disponíveis numa variedade de nomes comerciais. Polieletrólitos são classificados de acordo com a carga elétrica na cadeira do polímero, os carregados positivamente são chamados de catiônicos e os que não possuem carga elétrica são os não-iônicos. Os Antônimos e os não-iônicos são geralmente utilizados com coagulantes metálicos para promoverem a ligação entre os coloides, a fim de desenvolver flocos maiores e mais resistentes.
A dosagem requerida de um auxiliar de coagulação é da ordem de 0,1 a 1,0 mg/L. Na coagulação de algumas águas, os polímeros podem promover floculação satisfatória, com significativa redução das dosagens de sulfato de alumínio. As vantagens potenciais são a reduções da quantidade de lodo e maior facilidade para desidratação.
- Polímeros Catiônicos: Tem sido usados com sucesso, em alguns casos, como coagulantes primários. Embora o custo destes polímeros seja maior que o do sulfato, as dosagens requeridas são reduzidas, podendo igualar o custo final. Adicionalmente, ao contrario do lodo gelatinoso e volumoso oriundo do sulfato de alumínio, o lodo formado pelo uso de polímeros é mais denso e fácil de ser desidratado, facilitando o manuseio e disposição. Algumas vezes, polímeros catiônicos e não-iônicos podem ser usados conjuntamente para formar um fluxo adequado, o primeiro sendo coagulante primário e segundo auxiliar de coagulação. Apesar de diversos avanços neste campo, existem varias águas que não podem ser tratadas apenas com polieletrólitos. Testes devem ser realizados para obtenção da eficiência um polieletrólito no tratamento de uma determinada água.
- Sílica Ativada: É o silicato de sódio tratado com ácido sulfúrico, sulfato de alumínio, dióxido de carbono ou cloro. Como auxiliar de coagulação ela apresenta as seguintes vantagens: aumenta a taxa de reação química, reduz a dosagem de coagulante, aumenta a faixa de pH ótimo e produz um floco com melhores propriedades de decantação e resistência. A desvantagem em relação aos polieletrólitos é a necessidade de um controle preciso de preparo e dosagem.
Dosagem de 7 a 11% da dosagem do coagulante primário expresso em mg/L de SiO2. Quando utilizada junto com o sulfato de alumínio ou sulfato ferroso, a sílica, por sua elevada carga negativa, promove a formação de flocos maiores, mais densos e resistentes, o que aumenta a eficiência de coagulação. A sílica, mesmo um pequenas quantidades causa prejuízos as caldeiras à vapor.
- Argilas Bentoniticas: Usadas no tratamento de águas contendo alto teor de cor, baixa turbidez e baixo conteúdo mineral. Nestas condições, os flocos de Fe ou Al são demasiadamente leves para decantar rapidamente. A adição da argila resulta num aumento de peso do floco melhorando a decantabilidade. A dosagem deve ser feita na forma de testes mas as dosagens são da ordem de 10 a 15 mg/L.
- Carvão Ativado: Aplicam na forma de pó, tem grande poder de adsorção. É bastante empregada no tratamento da água com gosto e odor provocador por material orgânico.
- Ácido Sulfúrico: É usado como auxiliar na coagulação de águas de cor e pH bastante elevados.
“A SNatural tem estoque local de produtos químicos, enzimas, resinas e meios filtrantes diversos. “